Oggi, la cura contro il Melanoma è sempre più efficace ed ha contribuito a dare una svolta decisiva nella sopravvivenza del paziente.
Se prima del 2011 le chemioterapie avevano un beneficio limitato con una sopravvivenza in media di 9 mesi, le nuove cure, che si basano sull’immunoterapia, sono in grado di garantire ai pazienti una remissione maggiore, in media 18 mesi, e in alcuni casi completa.
Tutto ciò è possibile grazie ai nuovi approcci terapeutici dell’immunoterapia che agiscono su specifici bersagli nella lotta contro il Melanoma avanzato (non resecabile o metastatico).
Cosa è l’immunoterapia?
L’immuniterapia, a differenza della chemioterapia, è in grado di potenziare il sistema immunitario del paziente nella lotta contro il Melanoma, un tumore che ha uno dei più alti tassi di mutazione.
I farmaci immunterapici, attualmente utilizzati da soli o in combinazione per la cura del Melanoma avanzato (non resecabile o metastatico) sono: Ipilimumab (Yervoy®), Nivolumab (Opdivo®) e Pembrolizumab (Keytruda®).
Quando usati in combinazione si usano: Ipilimumab e Nivolumab oppure Ipilimumab e Pembrolizumab.
Sono tutti anticorpi monoclonali indicati per il trattamento di pazienti con Melanoma avanzato (non resecabile o metastatico).
Approfondimento da non perdere
Il Melanoma: cos’è, come si manifesta, i segni e i sintomi
Cosa è un anticorpo monoclonale?
L’anticorpo monoclonale è una sostanza prodotta in laboratorio da un solo tipo di cellula (clone cellulare) del sistema immunitario.
In laboratorio è possibile produrre molteplici anticorpi monoclonali identici tra loro.
Gli anticorpi monoclonali sono in grado di interagire in maniera specifica con sostanze estranee o pericolose per l’organismo, chiamate antigeni, neutralizzandole.
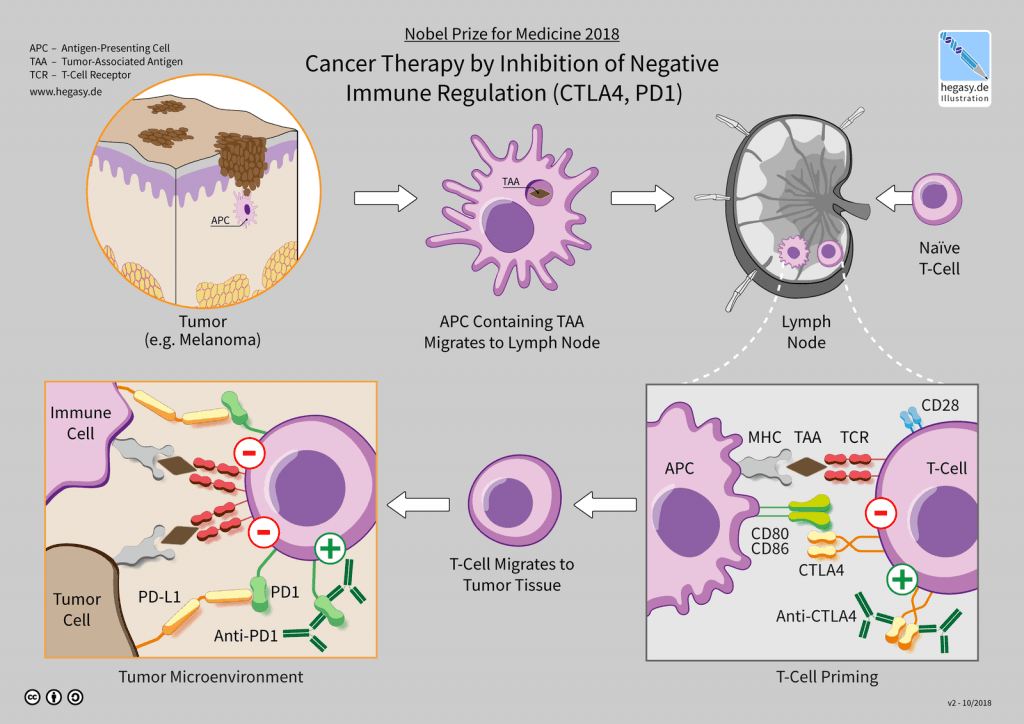

E’ proprio grazie alla loro azione di interagire con specifici bersagli che vengono utilizzati nella cura contro i tumori in genere, Melanoma compreso.
In campo terapeutico, gli anticorpi monoclonali utilizzati terminano tutti con un suffisso che varia in base al tipo di anticorpo:
- -umab se è di origine umana
- -zumab se la sua struttura contiene il 5-10% di aminoacidi di origine murina
- -ximab quando la sua struttura è chimerica in quanto presenta circa il 34% di aminoacidi di origine murina e la restante di orine umana
- -mab se è di origine murina
Che cos’è e come agisce Ipilimumab (Yervoy®)?
Ipilimumab è un anticorpo monoclonale anti-CTLA-4 (IgG1κ) interamente umano, prodotto in cellule ovariche di criceto cinese mediante la tecnologia del DNA ricombinante.
Può essere usato in monoterapia negli adulti e nei bambini a partire dai 12 anni di età o in associazione a Nivolumab.
Il CTLA-4 è un recettore transmembrana dei Linfociti T citotossici che in seguito all’interazione con specifici ligandi è in grado di attivare una risposta inibitoria della funzione dei linfociti T citotossici, identificati anche come CD8+.
I linfociti T citotossici sono linfociti del nostro sistema immunitario in grado di eliminare le cellule infette e quelle tumorali.
Se questa loro azione viene inibita, come descritta sopra, il sistema immunitario della persona non è in grado di svolgere l’azione di distruzione nei confronti delle cellule infette e soprattutto delle tumorali quali appunto quelle del Melanoma.
L’Ipilimumab interagendo e saturando i recettori CTLA-4 non li rende più disponibili per i ligandi accennati e di conseguenza i linfociti T citotossici non vengono inibiti.
I linfociti T citotossici quindi sono in grado di proliferare e di infiltrare le cellule tumorali di Melanoma in modo tale da distruggerle.
Come si somministra Ipilimumab (Yervoy®)?
Ipilimumab deve essere somministrato per via endovenosa in periodo di 90 minuti.
Può essere somministrato non diluito o diluito in una soluzione iniettabile di sodio cloruro 9 mg/ml (0,9%) oppure in una soluzione iniettabile di glucosio 50 mg/ml (5%) a concentrazioni comprese tra 1 e 4 mg/ml. Ipilimumab non deve essere somministrato per via endovenosa rapida o con iniezione in bolo.
Qual è il dosaggio di Ipilimumab (Yervoy®)?
Inizialmente è prevista la fase di induzione che deve essere completata dai paziente in base alla tollerabilità e indipendentemente dalla comparsa di nuove metastasi o dalla crescita di quelle già esistenti e che consiste nella somministrazione di 4 dosi, una ogni 3 settimana. Ogni dose deve essere somministrata per via endovenosa in un periodo di 90 minuti.
Terminata la fase di induzione è possibile valutare la risposta tumorale del Melanoma al trattamento.
Prima di iniziare la terapia con Ipilimumab è necessario valutare la funzionalità tiroidea ed epatica, indagini che devono essere ripetute prima della dose successiva della terapia di induzione.
La dose raccomandata di Ipilimumab è di 3 mg per chilogrammo di peso corporeo.
Qualora, il paziente fosse trattato con Ipilimumab e Nivolumab in combinazione riceve riceve una dose di entrambi gli immunoterapici ogni 3 settimane per un totale di 4 dosi, per poi essere trattato con Nivolumab in monoterapia.
Quali sono gli effetti collaterali di Ipilimumab (Yervoy®)?
Gli effetti collaterali possono essere diversi e a carico di diversi organi. In base alla gravità e all’entità degli effetti collaterali, l’oncologo valuterà se interrompere in permanentemente il trattamento con Ipilimumab oppure sospendere solo una dose.
Gli effetti collaterali possibili sono:
- Gastrointestinali > dolore addominale, diarrea severa o cambiamento significativo della frequenza delle evacuazioni, presenza di sangue nelle feci, emorragia gastrointestinale, perforazione gastrointestinale
- Epatici > aumento dei valori delle transaminasi (GOT e GPT) e della bilirubina totale
- Cutanei > sindrome di Stevens-Johnson (Necrolisi tossica epidrmica), prurito severo e diffuso
- Neurologici > neuropatia sensitiva o motoria
- Endocrini > ipofisite e tiroidite
- vari > nefrite, polmonite, pancreatite, miocardite non infettiva
Che cos’è e come agisce Nivolumab (Opdivo®)?
Nivolumab è un anticorpo monoclonale di origine umana antiPD-1, prodotto in cellule di ovaio di criceto cinese mediante tecnologia del DNA ricombinante, in grado di inibire il checkpoint immunitario PD-1 (programmed cell death-1).
I checkpoint immunitari sono delle molecole che modulano e regolano l’attività del sistema immunitario.
PD-1 è uno di questi checkpoint immunitario, utilizzato dalla cellule tumorali per eludere il sistema immunitario della persona dall’attacco ed evitare di essere attaccate. Le cellule tumorali, quali quelle del Melanoma, utilizzano tale via del sistema PD-1 per bloccare le risposta del sistema immunitario della persona.
Nivolumab bloccando il PD-1 evita che il sistema immunitario venga inibito nella sua azione di distruzione delle cellule tumorali.
Come si somministra Nivolumab (Opdivo®)?
Nivolumab è somministrato per via endovenosa con una somministrazione lenta della durata di 60 minuti. La soluzione per infusione deve essere somministrata attraverso un filtro in linea, sterile, apirogeno, a basso legame proteico con dimensione dei pori da 0,2 a 1,2 μm.
Il trattamento deve essere continuato finché si osserva un beneficio clinico o fino a quando il trattamento non sia più tollerato dal paziente.
Qual è il dosaggio di Nivolumab (Opdivo®)?
La dose raccomandata di Nivolumab è di 3 mg per chilogrammo di peso corporeo, somministrata per via endovenosa in 60 minuti ogni 2 settimane.
Se inveve Nivolumab è somministrato in associazione ad Ipilimumab la dose raccomandata è 1 mg per chilogrammo di peso corporeo di Nivolumab somministrato per infusione endovenosa in un periodo di 60 minuti ogni 3 settimane per le prime 4 dosi in associazione a 3 mg per chilogrammo di peso corporeo di Ipilimumab somministrato per via endovenosa in un periodo di 90 minuti. A seguire la seconda fase nella quale sono somministrati 3 mg per chilogrammo di peso corporeo di Nivolumab per infusione endovenosa in un periodo di 60 minuti ogni 2 settimane.
Il trattamento immunoterapico, sia in monoterapia sia in associazione ad Ipilimumab, deve essere continuato finché si osserva un beneficio clinico o fino a quando il trattamento non sia più tollerato dal paziente.
Non è raccomandato l’aumento graduale o la riduzione della dose.
Chiare linee guida definiscono quando il trattamento deve essere interrotto in maniera permanente oppure deve esserci la sospensione delle dosi.
Quali sono gli effetti collaterali di Nivolumab (Opdivo®)?
Le reazioni avverse possono essere:
- Polmonite
- Colite e diarrea
- Epatite > aumento delle transaminasi (GOT e GPT) e della bilirubina totale
- Nefrite e disfunzione renale > aumento della creatinina
- Endocrinopatie > ipotiroidismo, ipertiroidismo, ipofisite, Insufficienza surrenalica, Diabete
- Reazioni avverse cutanee > rash, Sindrome di Stevens-Johnson (SJS)
- Varie > miocardite
Che cos’è e come agisce Pembrolizumab (Keytruda®)?
E’ un anticorpo monoclonale che ha un meccanismo d’azione del tutto simile a quello di Nivolumab.
Pembrolizumab è un anticorpo monoclonale umanizzato (isotipo IgG4/kappa con un’alterazione stabilizzante di sequenza nella regione Fc) anti PD-1 (programmed cell death-1) prodotto in cellule ovariche di criceto cinese con la tecnologia del DNA ricombinante.
Come si somministra Pembrolizumab (Keytruda®) ?
Deve essere somministrato mediante infusione endovenosa (somministrazione goccia a goccia), attraverso una cannula (tubisino) introdotto nella vena del braccio o del dorso della mano.
Ogni infuzione dura circa 30 minuti e viene ripetuta ogni 3 settimane.
Qual è il dosaggio di Pembrolizumab (Keytruda®)?
La dose di Pembrolizumab è di 2 mg per chilogrammo di peso corporeo.
Il trattamemto deve essere eseguito fino a quando non viene documentata la progressione del Melanoma o fino alla comparsa di tossicità inaccettabile.
Durante il trattamento con Pembrolizumab sono state osservate risposte atipiche caratterizzate da un aumento transitorio ed iniziale delle dimensioni del tumore o la comparsa di nuove piccole lesioni metastatiche nei primi mesi e riduzione successiva della massa tumorale.
Per questo motivo nei pazienti clinicamente stabili che presentano evidenza iniziale di progressione della malattia si raccomanda la prosecuzione del trattamento fino alla conferma della progressione.
Quali sono gli effetti collaterali di Pembrolizumab (Keytruda®)?
Quando un paziente esegue l’immunoterapia con Pembrolizumab gli effetti avversi che possono verificarsi sono:
- Sintomi simil influenzali
- Polmonite
- Nausea, vomito, diarrea e colite
- Nefrite
- Rash cutaneo, Prurito diffuso, Vitiligine, Secchezza della pelle
- Endocrinopatie > Ipofisite, Diabete di Tipo 1
- Epatite > aumento delle transaminasi (GOT, GPT) e della bilirubina totale
Anche in questo caso somno state definite linee guida per il medico per valutare quando interrompere permanentemente il trattamento o sospendere la somministrazione delle dosi.
Dermaforum: partecipa anche tu alla conversazione
Autocontrollo dei nei: la regola ABCD e ABCDEFG
Quali sono gli esami del sangue che il paziente con Melanoma deve eseguire?
Se da un lato sono stati fatti notevoli progressi per il trattamento del Melanoma, ci sono ancora delle limitazioni in quanto non è possibile sapere a priori quali saranno i pazienti con Melanoma avanzato che risponderanno in maniera ottimale alle nuove cure.
Allo steso modo non sono stati fatti, negli ultimi 10 anni, sostanziali progressi circa i parametri del sangue del paziente con Melanoma da monitorare.
Valore LDH alto e Melanoma
Nel 2009, la lattato deidrogenasi (LDH) ha dimostrato di essere un predittore indipendente di sopravvivenza nel Melanoma, motivo per cui è stata aggiunta alle linee guida AJCC.
Se LDH è alto può avere un valore prognostico ha un significato prognostico, negativo anche se devono essere sempre valutati ed esclusi possibili falsi positivi, ovvero quelle condizioni che potrebbero aver favorito un aumento dell’enzima ma non dovute a cause tumorali.
LDH è un utile marker per monitorare il decorso del Melanoma in modo tale che il dermatologo e l’oncologo possano valutare le più opportune decisioni terapeutiche.
Valore Proteina S100 alto e Melanoma
E’ un marker per monitorare il Melanoma e lo stadio clinico della malattia.
S100 ha dimostrato di essere predittivo della risposta al trattamento con l’anticorpo monoclonale anti-CTLA-4.
Così come l’LDH, S100 sembra essere un indicatore dello stadio della malattia in quei pazienti che a causa della fase avanzata di Melanoma potrebbero non rispondere all’immoterapia.
Valore Proteina C reattiva (PCR) alto e Melanoma
La proteina C-reattiva (CRP) è stata descritta come fattore prognostico negativo per il trattamento con l’anticorpo monoclonale anti-CTLA-4.
A differenza di LDH e S100, la PCR è direttamente correlata alla risposta immunitaria.
In generale è un marker di infiammazione e non è specifico per il Melanoma, motivo per cui suo aumento può essere dovuti a molteplici altre cause o infezioni in atto.
Nuovi Biomarcatori
La ricerca sta cercando di valutare quali potrebbero essere altri parametri da valutare per monitorare il paziente con Melanoma e soprattutto per capire quale potrebbe essere la sua possibile risposta al trattamento di Immunterapia.
In alcuni studi ad esempio è stata valutata con l’immunoistochimica l’espressione di PD-L1 da parte del Melanoma, anche se saranno necesarie ulteriori ricerche per standardizzare la valutazione dell’espressione di PD-L1 affinché diventi un biomarker attendibile.
In altri studi sono stati presi in esami e potrebbero essere rilevanti i seguneti valori del sangue:
- numero dei Neutrofili
- numero di Linfociti
- Rapporto tra i Neutrofili e i Linfociti
- Numero di Eosinofili
- Numero dei Monociti
- TGFβ
Conclusioni
Se da un lato i dermatologi sono sempre più in grado di formulare una diagnosi precoce del Melanoma, dall’altro la ricerca sta facendo notevoli passi avanti nella cura con l’immunoterapia per la cura delle persone con Melanoma avanzato non operabile o con metastasi.
Sono persone che grazie a questo nuovo approccio mirato sul Melanoma continuo a vivere la loro vita contando su una remissione della malattia che si preannuncia sempre più importante.
Persone, alcune delle quali hanno condiviso la loro storia con noi di Myskin ma anche con voi. Sul nostro canale Youtube puoi trovare le storie vere di persone vere con Melanoma in #myskinstories
Riferimenti Scientifici
- Luke JJ, Flaherty KT, Ribas A, Long GV. Targeted agents and immunotherapies: optimizing outcomes in melanoma. Nat Rev Clin Oncol (2017) 14(8):463–82. doi:10.1038/nrclinonc.2017.43
- Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol (2009) 27(36):6199–206. doi:10.1200/JCO.2009.23.4799
- Fantin VR, St-Pierre J, Leder P. Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance. Cancer Cell (2006) 9(6):425–34. doi:10.1016/j.ccr.2006.04.023
- Gershenwald JE, Scolyer RA, Hess KR, Sondak VK, Long GV, Ross MI, et al. Melanoma staging: evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin (2017) 67(6):472–92. doi:10.3322/caac.21409
- Kelderman S, Heemskerk B, van Tinteren H, van den Brom RR, Hospers GA, van den Eertwegh AJ, et al. Lactate dehydrogenase as a selection criterion for ipilimumab treatment in metastatic melanoma. Cancer Immunol Immunother(2014) 63(5):449–58. doi:10.1007/s00262-014-1528-9
- Diem S, Kasenda B, Spain L, Martin-Liberal J, Marconcini R, Gore M, et al. Serum lactate dehydrogenase as an early marker for outcome in patients treated with anti-PD-1 therapy in metastatic melanoma. Br J Cancer (2016) 114(3):256–61. doi:10.1038/bjc.2015.467
- Kaskel P, Berking C, Sander S, Volkenandt M, Peter RU, Krähn G. S-100 protein in peripheral blood: a marker for melanoma metastases: a prospective 2-center study of 570 patients with melanoma. J Am Acad Dermatol (1999) 41(6):962–9. doi:10.1016/S0190-9622(99)70254-9
- Li Z, Feng J, Sun X. Is C-reactive protein a specific marker in melanoma? J Clin Oncol (2015) 33(31):3673–4. doi:10.1200/JCO.2015.62.2696
- Alexandrov LB, Nik-Zainal S, Wedge DC, Aparicio SA, Behjati S, Biankin AV, et al. Signatures of mutational processes in human cancer. Nature (2013) 500(7463):415–21. doi:10.1038/nature12477
- Hayward NK, Wilmott JS, Waddell N, Johansson PA, Field MA, Nones K, et al. Whole-genome landscapes of major melanoma subtypes. Nature (2017) 545(7653):175–80. doi:10.1038/nature22071
- Cancer Genome Atlas Network. Genomic classification of cutaneous melanoma. Cell (2015) 161(7):1681–96. doi:10.1016/j.cell.2015.05.044








